
O sistema periódico dos elementos é um arranjo que representa os elementos químicos. Normalmente, o sistema periódico de elementos é organizado em forma tabular.
O arranjo do sistema periódico dos elementos é baseado em números atômicos, configurações eletrônicas e propriedades químicas.
A seguir está o arranjo do sistema periódico de elementos:
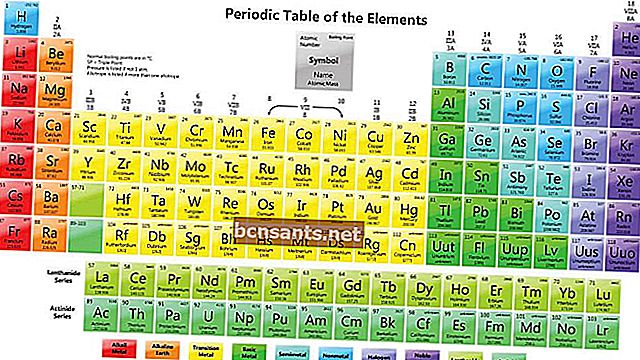
Como ler os elementos no sistema periódico dos elementos
No SPU, você encontrará a escrita de cada elemento conforme mostrado abaixo.
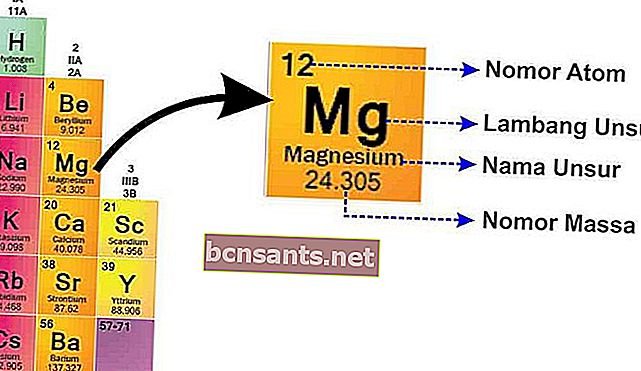
A partir desta imagem, ele pode explicar:
- Número de massa
O número de massa é o núcleo do átomo que tem uma carga positiva porque existem prótons que são carregados positivamentee nêutrons que são neutros
- Número atômico
O número atômico informa o número de prótons, porque o átomo é neutro, o número atômico também informa o número de elétrons .
Agrupamentos de Elementos
No sistema periódico de elementos, cada elemento é agrupado de acordo
- Grupo
Os grupos estão na coluna vertical da tabela do sistema periódico de elementos. Os elementos que estão no mesmo grupo terão a mesma configuração de elétrons de valência.

- Período
Os pontos são os elementos que estão em uma linha horizontal na tabela de elementos do sistema periódico. O período mostra a energia de ionização , raio atômico, afinidade eletrônica e eletronegatividade.

- Quadra
Um bloco representa uma coleção de elementos que possuem a mesma subcamada de elétrons de valência.

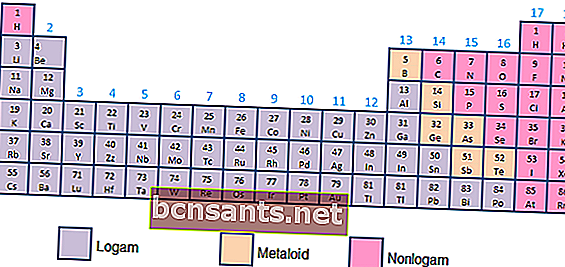
- Metais, metalóides e não metais
Com base nas propriedades químicas e físicas, os elementos podem ser categorizados como metais (alta condutividade), metaloides (condutividade entre metais e não metais) ou não metais (não possuindo propriedades de condutividade, na forma de gases).
Energia de ionização, raio atômico, afinidade eletrônica e eletronegatividade
Energia de ionização, raio atômico, afinidade eletrônica e eletronegatividade podem ser vistos com base nos períodos e grupos de elementos no sistema elementar.
Leia também: Como você identifica os corpos das vítimas de acidentes aéreos?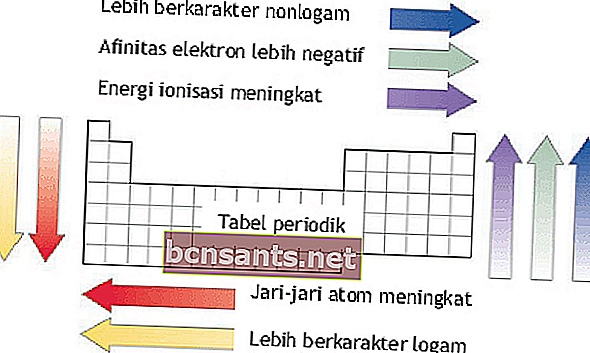
Energia de ionização
Energia de ionização é a energia necessária para remover um elétron externo de um átomo no estado gasoso.
Dentro de um período, a energia de ionização aumenta da esquerda para a direita conforme o número atômico aumenta.
Dentro de um grupo, as energias de ionização diminuem de cima para baixo à medida que o número atômico aumenta.
Raio atômico
O raio atômico é a distância do núcleo atômico à trajetória mais externa do átomo.
Em um período, o raio atômico aumenta de cima para baixo.
Dentro de um grupo, o raio atômico aumenta da direita para a esquerda.
Afinidade de elétron
A afinidade eletrônica é a energia liberada por um átomo em seu estado gasoso para formar íons negativos.
Em um período, a afinidade eletrônica aumenta de baixo para cima. Dentro de um grupo, a afinidade eletrônica aumenta da esquerda para a direita.
Eletro-negatividade
Eletronegatividade é o valor da tendência de um átomo de atrair elétrons na formação de ligações químicas. Esta propriedade é importante na formação de ligações entre átomos.
Em um período, a eletronegatividade aumenta de baixo para cima.
Em um período, a eletronegatividade aumenta da esquerda para a direita.
Referência
- Tabela Periódica dos Elementos
- //www.studiobelajar.com/sistem-periodic-elements/
