Uma solução é uma mistura homogênea que consiste em duas ou mais substâncias, enquanto a solubilidade é a quantidade máxima de um composto ou substância que pode se dissolver em vários solventes .
Muitas das várias soluções que encontramos na vida cotidiana incluem um copo de xarope doce. Em um copo de xarope existem vários componentes, nomeadamente água, xarope e açúcar.
Se esses componentes forem misturados até que os componentes constituintes não sejam mais visíveis, isso se torna uma solução.
Discutir a solução, após uma revisão adicional inclui a definição, propriedades, tipos e fatores da solução.
Definição de solução e solubilidade

Solução
Uma solução é uma mistura homogênea que consiste em duas ou mais substâncias. Chamado de solução por causa dos componentes constituintes da solução.
Em uma solução, existem solventes e solutos. Soluto (soluto) é uma substância que compõe uma solução que possui uma quantidade menor em uma solução. Enquanto isso, o solvente (solvente) é uma substância mais abundante que o soluto.
A composição da substância marinha em solução é expressa pela concentração da solução. Enquanto o processo de mistura de um soluto e um solvente para formar uma solução é chamado de dissolução ou solvatação.
Para entender mais sobre a solução, considere a seguinte imagem de ilustração.
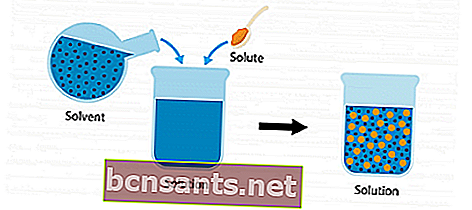
Existe um soluto e um solvente. Quando os dois ingredientes são misturados e combinados em um recipiente, torna-se uma solução.
Solubilidade (s)
A definição de solubilidade é a quantidade máxima de um composto ou substância que pode se dissolver em vários solventes.
A solubilidade é simbolizada por s (solibilidade) em unidades mol / L ou geralmente usa unidades de molaridade M. Aqui está a fórmula para solubilidade ou molaridade.
M = n / V
onde M é a molaridade (mol / L), n é o número de moles da substância (mol) e V é o volume da solução ou solvente (L).
A solubilidade também é definida como a concentração de uma substância que ainda pode se dissolver em uma determinada quantidade de solvente.
Produto de solubilidade constante (Ksp)
Um soluto dissolvido em um solvente formará uma reação de equilíbrio. A ocorrência de equilíbrio é influenciada por solutos insolúveis e íons solutos.
Leia também: 100+ exemplos de palavras padrão e não padrão + explicações [ATUALIZADO]A seguir está um exemplo da constante de equilíbrio para uma reação.
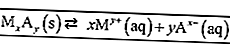
De acordo com as regras para escrever a fórmula de equilíbrio, apenas as substâncias na forma de solução (aq) e gás (s) são escritas na fórmula. Para que seja obtido:
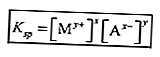
A constante de equilíbrio para uma solução que é difícil de dissolver é chamada de constante do produto de solubilidade (Ksp).
Propriedades da Solução

As propriedades físicas que aparecem na solução são divididas em três, a saber:
1. Propriedades coligativas de soluções
É uma característica da solução que depende do número de partículas de soluto em uma solução e não depende do tipo de partículas de solvente.
As propriedades coligativas são equivalentes à concentração de várias substâncias não eletrolíticas em solução, independentemente do tipo ou das propriedades químicas dos constituintes.
Ao determinar as propriedades coligativas de uma solução de sólidos em um líquido, o sólido é considerado não volátil e a pressão de vapor acima da solução vem inteiramente do solvente.
Algumas das propriedades coligativas de uma solução são pressão osmótica, diminuição da pressão de vapor, aumento do ponto de ebulição e diminuição do ponto de congelamento.
2. Propriedades aditivas
Em solução, as propriedades aditivas são propriedades de uma solução que dependem do total de átomos na molécula ou do número de propriedades constituintes da solução.
Um exemplo das propriedades aditivas de uma solução é seu peso molecular, que é a soma das massas atômicas.
A massa dos componentes de uma solução está incluída nas propriedades do aditivo, a massa total da solução é a quantidade de cada componente da solução, nomeadamente o soluto e o solvente.
3. Natureza Constitutiva
Isso inclui a natureza da solução, que depende dos átomos da molécula (do tipo de átomo e do número de átomos). Suas propriedades constitutivas indicam as regras de compostos individuais e grupos de moléculas no sistema.
Existem várias propriedades físicas que são parcialmente aditivas e constitutivas. Entre eles estão a refração da luz, propriedades elétricas, propriedades superficiais e inter-superficiais que estão incluídas em alguns aditivos e em alguns aditivos.
Tipo de Solução

1. Solução Insaturada
Solução insaturada significa uma solução que contém menos soluto do que o necessário para fazer uma solução saturada. As soluções insaturadas contêm partículas que não reagiram adequadamente com a substância, ou seja, ainda podem dissolver a substância.
A solução é dita insaturada quando o valor da concentração de íons <Ksp. Em uma solução insaturada, não há deposição de soluto.
Leia também: Definição de soluções químicas e seus tipos e componentes2. Solução Saturada
Uma solução é incluída em uma solução saturada quando há um equilíbrio entre o soluto e o solvente. Em uma solução saturada, as partículas reagem com o reagente ou experimentam a concentração máxima.
A solução é considerada saturada se a concentração de íons for igual ao valor Ksp. Nesta condição de equilíbrio, a velocidade do soluto no solvente é a mesma que a taxa na qual ele se assenta. Ou seja, a concentração da substância na solução é a mesma.
3. Solução Altamente Saturada
Essa é uma solução que contém mais soluto do que o solvente. Isso faz com que o valor do produto da concentração de íons> Ksp de modo que a solução fique saturada e se assente.
Fator de Solubilidade

A solubilidade de um líquido varia. Isso é influenciado por vários fatores de solubilidade. Aqui estão alguns dos fatores de solubilidade.
1. Temperatura
O nível de temperatura da solução afeta o processo de dissolução do soluto. Em temperaturas mais altas, o soluto se dissolverá prontamente no solvente.
Isso ocorre porque as partículas sólidas em temperaturas mais altas se movem mais rapidamente, permitindo colisões mais frequentes e eficazes.
2. O tamanho do soluto
Quanto menores forem os grânulos de soluto, mais fácil ele se dissolverá no solvente. A pequena quantidade de grânulos de soluto faz com que a área de superfície da substância seja mais larga e se espalhe em uma solução.
Quanto maior a área de superfície da substância, mais partículas colidem umas com as outras. Isso é o que faz com que o processo de dissolução ocorra mais rápido.
3. Volume de solvente
O grande volume do solvente afeta o processo de dissolução da substância. Isso ocorre porque mais e mais partículas de solvente reagem com o soluto.
Quanto mais volume de solvente usado, mais rápido será o processo de dissolução do soluto.
4. Velocidade de mistura
O processo de dissolução será mais rápido se você adicionar o fator de agitação.
Ao agitar, as partículas de soluto são cada vez mais misturadas com o solvente, de modo que a reação de dissolução é mais rápida do que a de dissolver sem agitação.
Esta é uma explicação da solução e solubilidade junto com o significado, propriedades, tipos e fatores. Pode ser útil.
